ThS. Vũ Thu Hằng
Khoa Hỗ trợ Sinh sản, Bệnh viện Sản Nhi Quảng Ninh
GIỚI THIỆU
Môi trường nuôi cấy phôi không chỉ là nguồn dinh dưỡng cần thiết cho sự phát triển của giao tử và phôi trong thụ tinh trong ống nghiệm (TTTON) đến khi phôi được chuyển vào buồng tử cung, mà còn cung cấp một loạt thành phần hỗ trợ giúp các phản ứng sinh lý của phôi được diễn ra tối ưu, ví dụ như các nhân tố tăng trưởng, kháng sinh, chất bắt ion kim loại, chất chống oxy hóa1. Trong đó, chất chống oxy hóa có vai trò quan trọng trong điều hòa, giảm thiểu căng thẳng oxy hóa ở tế bào giao tử và phôi. Ban đầu, một số acid amin (ví dụ: glutathione, citrate, …) được bổ sung như nhóm chất chống oxy hóa, tuy nhiên những chất này có thời gian bán hủy ngắn và thường bị oxy hóa nhanh chóng nên không phù hợp cho các sản phẩm được thương mại hóa2. Hiện nay, những ứng dụng của mô hình nhóm chất chống oxy hóa trong môi trường nuôi cấy phôi ngày càng hoàn thiện, an toàn và dễ tiếp cận.
NGUỒN GỐC CĂNG THẲNG OXY HÓA TRONG TTTON
Căng thẳng oxy hóa (Oxidative stress) được định nghĩa là sự mất cân bằng giữa các gốc oxy phản ứng (Reactive oxygen species – ROS) và tổng lượng chất chống oxy hóa (Antioxidants)3. ROS tồn tại phổ biến trong tế bào cơ thể người, các dạng điển hình bao gồm: hydrogen peroxide, superoxide, hydroxyl, … chúng không ổn định và có tính phản ứng cao, nồng độ ROS cao vượt ngưỡng là nguyên nhân chính gây ra căng thẳng oxy hóa. Trong TTTON, ROS có nguồn gốc nội sinh do hoạt động biến dưỡng của giao tử/phôi được nuôi cấy hoặc từ các nguồn ngoại sinh khác (môi trường phòng lab và môi trường nuôi cấy) (Hình 1). Tiêu biểu, oxy trong khí quyển (nồng độ 20 – 21%) là một trong những yếu tố đầu tiên tạo ra căng thẳng oxy hóa, gây độc cho phôi bắt đầu từ giai đoạn nén4, bởi hầu hết các mô cơ thể, bao gồm cả ống dẫn trứng, hoạt động bình thường ở nồng độ oxy từ 4% đến 10%. Ngoài oxy, không khí trong phòng nuôi cấy phôi, nguồn khí cung cấp cho các tủ nuôi cấy, vật tư tiêu hao hỗ trợ sinh sản (nhựa, bisphenol) và chất lượng môi trường nuôi cấy cũng góp phần quyết định mức độ căng thẳng oxy hóa5. Bên cạnh đó, các yếu tố dễ dàng biến đổi do điều kiện nuôi cấy nhân tạo như ánh sáng, nhiệt độ và độ ẩm có thể trực tiếp hoặc gián tiếp kích hoạt căng thẳng oxy hóa6. Hơn nữa, ROS có thể được tạo ra trong quá trình bảo quản lạnh – rã đông giao tử hoặc phôi, do đó làm tăng nguy cơ tổn thương các tế bào này7. Tất cả các yếu tố này luôn tồn tại và có thể tác động ở bất kỳ giai đoạn nào trong TTTON, từ khâu chuẩn bị giao tử, thụ tinh đến quá trình chuyển phôi vào buồng tử cung.
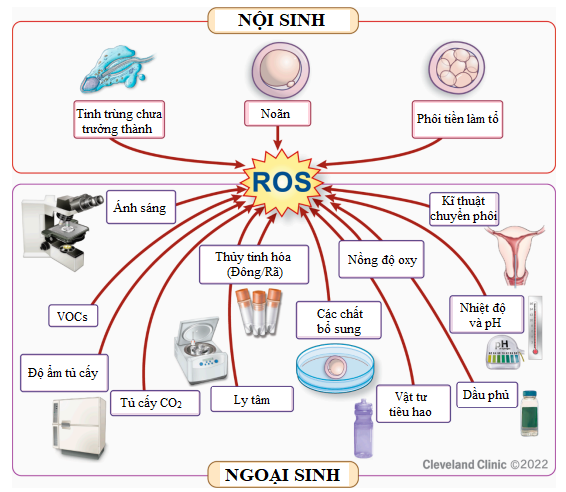
Hình 1. Nguồn gốc của ROS trong thụ tinh trong ống nghiệm8.
HỆ QUẢ CỦA CĂNG THẲNG OXY HOÁ
Ở nồng độ thấp, ROS hoạt động sinh lý như các phân tử truyền tín hiệu trong một số quá trình, ví dụ: sự sinh tinh, hình thành nang noãn, trưởng thành tinh trùng, phản ứng cực đầu trong thụ tinh, làm tổ và tạo nhau thai9. Tuy nhiên, khi nồng độ ROS cao bất thường có thể tác động đến phân tử lipid, protein, DNA, ti thể và có thể gây chết tế bào theo chu trình, phân mảnh phôi, thay đổi chức năng enzym và do đó ảnh hưởng đến sự phát triển tổng thể của phôi10. Quá trình peroxy hóa lipid do ROS gây ra dẫn đến sản xuất các sản phẩm có phản ứng cao và gây đột biến, chẳng hạn như malondialdehyde, một dấu hiệu phân tử gián tiếp quan trọng của căng thẳng oxy hóa. Ở tinh trùng, peroxy hóa lipid gây ra tổn thương và rối loạn chức năng màng ty thể, đồng thời làm giảm sản xuất adenosine triphosphate (ATP), cản trở quá trình hợp nhất tinh trùng và noãn11. Hơn nữa, mức độ bệnh lý của ROS có thể gây ra sự phân mảnh DNA của tinh trùng, đây là tác nhân có liên quan đáng kể đến chất lượng phôi thấp, tỷ lệ sảy thai cao12 và tỷ lệ sinh sống thấp sau hỗ trợ sinh sản.
CHIẾN LƯỢC CHỐNG CĂNG THẲNG OXY HÓA
Có hai hướng để giảm thiểu hậu quả từ căng thẳng oxy hóa dựa trên định nghĩa của nó, bao gồm: hạn chế việc sản sinh ROS và nâng cao nồng độ các chất chống oxy hóa.
Từ đây, ta có thể giảm nồng độ ROS bằng cách duy trì điều kiện nuôi cấy tối ưu cho giao tử và phôi, bắt đầu ngay từ bước thiết kế phòng nuôi cấy phôi, lựa chọn vị trí xây dựng dựa trên đánh giá các thông số môi trường để tránh những khu vực có mức ô nhiễm không khí gia tăng. Kiểm soát chất lượng, đảm bảo để các thông số, chẳng hạn như nhiệt độ phòng, độ ẩm, áp suất không khí và ánh sáng, luôn ở mức tối ưu; hệ thống lọc không khí đạt hiệu suất cao duy trì các chuẩn phòng sạch cần thiết cho nuôi cấy phôi13. Số lượng buồng nuôi cấy phải đủ cho số ca bệnh được điều trị, tùy thuộc vào loại và công suất của tủ nuôi cấy. Khoảng cách giữa các tủ nuôi cấy và khu vực thao tác phải càng ngắn càng tốt để giảm tổng thời gian cần thiết cho từng kỹ thuật và tránh các nguy cơ không mong muốn có thể xảy ra. Nâng cao trình độ chuyên môn, kĩ năng của chuyên viên phôi học để rút ngắn thời gian thao tác xử lý giao tử và phôi, …
Tuy nhiên, việc tiếp xúc của giao tử và phôi với các điều kiện không tối ưu về nhiệt độ, độ pH và oxy là không thể tránh khỏi, vì nhiều bước quan trọng trong TTTON, chẳng hạn như chọc hút noãn, thu nhận noãn, tiêm tinh trùng vào bào tương noãn và chuyển phôi được thực hiện bên ngoài buồng thao tác (IVF chamber). Vì vậy, ngay cả khi đĩa nuôi cấy phôi được đưa trở lại tủ nuôi cấy có khí, thì vẫn cần nhiều thời gian để cân bằng lại độ pH. Do đó, ngoài hạn chế sản sinh ROS, chiến lược cải thiện nồng độ các chất chống oxy hóa là một hướng tiếp cận sáng tạo, đầy hứa hẹn, và phương pháp bổ sung các chất chống oxy hóa vào môi trường nuôi cấy được đánh giá là khả thi và có hiệu quả.
SỰ KẾT HỢP BA CHẤT CHỐNG OXY HÓA TRONG MÔI TRƯỜNG NUÔI CẤY
Thay vì chỉ quan tâm vào các chất chống oxy hóa riêng lẻ, các công trình gần đây đã tập trung vào hiệu quả của nhóm các chất chống oxy hóa và đây là một cách tiếp cận sinh lý hơn. Cụ thể, thông qua nghiên cứu trên mô hình chuột, Truong và cộng sự (2016) đã xây dựng một môi trường nuôi cấy phôi kết hợp bộ ba chất chống oxy hóa với đúng nồng độ tối ưu nhất của từng thành phần, bao gồm: 5 µM axit alpha-lipoic, 10 µM acetyl-carnitine và 10 µM N-acetyl-L-cysteine. Bộ ba này có hiệu quả cao trong việc bảo vệ phôi đang phát triển khỏi căng thẳng oxy hóa ở cả nồng độ oxy 5% và 20%, đặc biệt là sự gia tăng số lượng tế bào phôi nang và khả năng làm tổ sau khi chuyển phôi14. Những nghiên cứu tiếp theo xác định rằng sự biểu hiện gen của thai nhi và nhau thai chuột thu được gần với các đối chứng phát triển in vivo hơn khi có mặt chất chống oxy hóa cho nuôi cấy phôi và thủy tinh hóa15.
KẾT QUẢ NGHIÊN CỨU LÂM SÀNG VỀ BỔ SUNG CHẤT CHỐNG OXY HÓA TRONG MÔI TRƯỜNG THỤ TINH TRONG ỐNG NGHIỆM
Từ năm 2018 đến nay, các nghiên cứu lâm sàng về bổ sung chất chống oxy hóa vào quá trình chuẩn bị giao tử cũng như nuôi cấy phôi người ngày càng phổ biến, phần lớn các nghiên cứu này đều dựa trên các sản phẩm đã thương mại hóa phát triển từ bộ ba chất chống oxy hóa được nhắc tới ở phần trước, kết quả bước đầu cho thấy dấu hiệu tích cực của việc nâng cao chất lượng phôi cũng như kết cục thai kỳ, đặc biệt ở nhóm bệnh nhân nữ lớn tuổi.
Kết quả phôi học và kết quả thai kỳ
Năm 2020, Gardner và cộng sự đã thực hiện nghiên cứu đối chứng ngẫu nhiên đa trung tâm trên 1563 noãn MII chị em từ 133 bệnh nhân tại hai trung tâm hỗ trợ sinh sản, kết quả cho thấy 50,2% số hợp tử thụ tinh được nuôi trong môi trường có bổ sung chất chống oxy hóa tạo phôi ngày 3 chất lượng tốt, tỷ lệ này cao hơn tỷ lệ 40,7% ở nhóm chứng (P < 0,05). Đồng thời, tỷ lệ làm tổ theo túi thai là 39,2% và 50,6%, và tỷ lệ thai lâm sàng lần lượt là 37,8% và 47,1% đối với nhóm chứng và nhóm bổ sung chất chống oxy hóa16. Bên cạnh đó, nghiên cứu của Phang Y. và cộng sự, năm 2024, về ảnh hưởng của việc bổ sung chất chống oxy hóa không chỉ trong quá trình nuôi cấy phôi mà còn kết hợp trong khâu chuẩn bị giao tử (noãn và tinh trùng), thực hiện trên 857 noãn chị em từ 50 bệnh nhân, nghiên cứu phát hiện tỷ lệ thụ tinh cao hơn có ý nghĩa thống kê ở nhóm sử dụng chất chống oxy hóa so với nhóm đối chứng ở nhóm bệnh nhân trẻ tuổi. Ở những bệnh nhân lớn tuổi, số lượng phôi nang tốt ngày 5, tỷ lệ phôi nang hữu dụng ngày 5 và tỷ lệ tổng phôi nang hữu dụng có xu hướng cao hơn ở nhóm có bổ sung chất chống oxy hóa. Tuy nhiên, kết quả nghiên cứu kết luận không có sự khác biệt khi so sánh tỷ lệ phôi nguyên bội giữa hai nhóm17.
Hiệu quả trên nhóm bệnh nhân nữ lớn tuổi
Khi kết quả phôi học và kết cục thai kỳ trong các nghiên cứu gần đây được phân tích trên nhiều nhóm đối tượng bệnh nhân khác nhau, cụ thể, việc phân tầng dựa theo nhóm tuổi đã đưa đến những nhận định ban đầu về hiệu quả điều trị TTTON kết hợp bổ sung chất chống oxy trong môi trường (chuẩn bị giao tử/ nuôi cấy phôi) đối với nhóm bệnh nhân nữ lớn tuổi. Theo đó, nghiên cứu của Gardner và cộng sự, năm 2020, cho thấy tỷ lệ làm tổ (tính theo số lượng túi thai) và tỷ lệ thai diễn tiến ở nhóm bệnh nhân từ 35 – 40 tuổi cao hơn đáng kể ở nhóm bổ sung chất chống oxy hóa (57,5% và 50,0%) so với nhóm chứng (23,5% và 25,8%), các so sánh này đều có ý nghĩa thống kê16. Ngược lại, khi phân tích dữ liệu trên nhóm bệnh nhân trẻ tuổi hay nhóm tổng hợp thì không thấy có sự khác biệt có ý nghĩa nào (Bảng 1). Tương tự, một nghiên cứu gần nhất về ảnh hưởng của chất chống oxy hóa lên kết quả phôi nang của Mizumoto và cộng sự được công bố đầu năm 2025 trên 127 chu kỳ TTTON cho ra tỷ lệ thụ tinh và tỷ lệ phôi nang ngày 5–6 trên mỗi noãn trưởng thành MII khác biệt đáng kể có lợi cho nhóm nghiên cứu, trong khi tỷ lệ phôi nang chất lượng tốt thì không. Trong khi đó, khi phân tích phân nhóm theo độ tuổi của bệnh nhân nữ, kết quả lại cho thấy sự cải thiện đáng kể ở nhóm nghiên cứu về tỷ lệ phát triển phôi ngày 3, tỷ lệ phôi nang ngày 5–6, tỷ lệ phôi nang chất lượng tốt và tỷ lệ phôi nang hữu dụng đối với bệnh nhân từ 35 – 40 tuổi. Thêm vào đó, trong 94 chu kỳ chuyển đơn phôi nang sau thủy tinh hóa từ các phôi trong nghiên cứu này, nhóm bệnh nhân 35 – 40 tuổi có kết quả tốt hơn nhóm trẻ tuổi18.
Bảng 1. Kết cục lâm sàng giữa các nhóm tuổi của bệnh nhân nữ theo nghiên cứu của Gardner và cs.16
|
|
Nhóm chứng |
Nhóm bổ sung chất chống oxy hóa (G-Series với A3*) |
||||
|
Nhóm tuổi |
Tất cả |
< 35 |
35 - 40 |
Tất cả |
< 35 |
35 - 40 |
|
Số chu kỳ chuyển phôi (ET) |
71 |
40 |
31 |
81 |
43 |
38 |
|
Số phôi chuyển |
74 |
40 |
34 |
85 |
45 |
40 |
|
Beta – hCG dương tính |
33 |
23 |
10 |
48 |
24 |
24 |
|
Làm tổ (túi thai) |
29 |
21 |
8 |
43 |
20 |
23 |
|
Làm tổ (có tim thai) |
28 |
20 |
8 |
40 |
20 |
20 |
|
Tỉ lệ thai diễn tiễn tiến (Thai diễn tiến/ET) |
28 |
20 |
8 |
38 |
19 |
19 |
|
* A3 biểu thị cho sự kết hợp sử dụng đồng thời ba chất chống oxy hóa acetyl-l-carnitine, N-acetyl-l-cysteine và alpha-lipoic acid. |
||||||
Hiệu quả trong điều kiện nuôi cấy phôi có gia tăng căng thẳng oxy hóa
Trong nghiên cứu hồi cứu của Ueno và cộng sự, năm 2021, trên 3610 chu kỳ TTTON và 1726 chu kỳ chuyển đơn phôi nang đông lạnh kết luận rằng bổ sung chất chống oxy hóa đã cải thiện tỷ lệ mang thai diễn tiến ở nhóm bệnh nhân nữ trên 39 tuổi nuôi cấy theo phương pháp theo dõi phôi truyền thống (lần lượt là 34,9% so với 27,0%; P < 0,05). Tuy nhiên, không có sự khác biệt về kết cục thai kỳ giữa hai nhóm khi sử dụng hệ thống nuôi cấy theo dõi phôi liên tục (time lapse)19. Kết quả này cho thấy các chất chống oxy hóa có thể thực sự có hiệu quả trong điều kiện nuôi cấy phôi chịu nhiều tác nhân gây căng thẳng oxy hóa đến từ quá trình đánh giá phôi bên ngoài tủ nuôi cấy, điển hình như việc phôi phải chịu cường độ ánh sáng lớn hay các thay đổi đột ngột về nhiệt độ và nồng độ CO2, O2, …
KẾT LUẬN
Giảm căng thẳng oxy hóa là mục tiêu rất quan trọng để tối ưu điều kiện nuôi cấy phôi trong TTTON, đồng thời chiến lược bổ sung chất chống oxy hóa trong môi trường nuôi cấy phôi là một hướng tiếp cận đầy hứa hẹn. Các bằng chứng tiền lâm sàng và lâm sàng ủng hộ việc sử dụng kết hợp bộ ba chất chống oxy hóa (axit alpha-lipoic, acetyl-carnitine và N-acetyl-L-cysteine), giúp bảo vệ giao tử và phôi khỏi các tác động của căng thẳng oxy hóa, nâng cao chất lượng phôi, cải thiện khả năng làm tổ, đặc biệt có hiệu quả ở nhóm bệnh nhân nữ lớn tuổi hoặc trong điều kiện nuôi cấy chịu căng thẳng oxy hóa cao. Tuy nhiên, để tối ưu hóa ứng dụng lâm sàng của nhóm các chất chống oxy hóa này, cần thêm nhiều các nghiên cứu đa trung tâm, đối chứng ngẫu nhiên với cỡ mẫu lớn hơn, bên cạnh đó, cũng cần đánh giá tác động dài hạn của nhóm chất này đối với sức khỏe của trẻ sinh sống.
TÀI LIỆU THAM KHẢO
1. Gardner DK, Lane M (2017). Embryo Culture Systems. In: Gardner DK and Simón C, editor. Handbook of in vitro fertilization, CRC Pres, 211-231.
2. Guerin P, El Mouatassin S, Menezo Y (2001). Oxidative stress and protection against reactive oxygen species in preimplantation embryos and its surroundings. Hum Reprod Update 7: 175-89.
3. VonMengden, L.; Klamt, F.; Smitz, J. Redox Biology of Human Cumulus Cells: Basic Concepts, Impact on Oocyte Quality, and Potential Clinical Use. Antioxid. Redox Signal. 2020, 32, 522–535.
4. Naillat, F.; Saadeh, H.; Nowacka-Woszuk, J.; Gahurova, L.; Santos, F.; Tomizawa, S.I.; Kelsey, G. Oxygen concentration affects de novo DNAmethylation and transcription in in vitro cultured oocytes. Clin. Epigenetics 2021, 13, 132.
5. Guérin, P.; El Mouatassim, S.; Ménézo, Y. Oxidative stress and protection against reactive oxygen species in the pre-implantation embryo and its surroundings. Hum. Reprod. Update 2001, 7, 175–189.
6. Goto, Y.; Noda, Y.; Mori, T.; Nakano, M. Increased generation of reactive oxygen species in embryos cultured in vitro. Free Radic. Biol. Med. 1993, 15, 69–75.
7. Castro, L.S.; Hamilton, T.R.; Mendes, C.M.; Nichi, M.; Barnabe, V.H.; Visintin, J.A.; Assumpção, M.E. Sperm cryodamage occurs after rapid freezing phase: Flow cytometry approach and antioxidant enzymes activity at different stages of cryopreservation. J. Anim. Sci. Biotechnol. 2016, 7, 17.
8. Agarwal A, Maldonado Rosas I, Anagnostopoulou C, Cannarella R, Boitrelle F, Munoz LV, Finelli R, Durairajanayagam D, Henkel R, Saleh R. Oxidative Stress and Assisted Reproduction: A Comprehensive Review of Its Pathophysiological Role and Strategies for Optimizing Embryo Culture Environment. Antioxidants. 2022; 11(3):477.
9. Silva, E.; Almeida, H.; Castro, J.P. (In) Fertility and Oxidative Stress: New Insights into Novel Redox Mechanisms Controlling Fundamental Reproductive Processes. Oxid. Med. Cell. Longev. 2020, 2020, 4674896.
10. Lettieri, G.; D’Agostino, G.; Mele, E.; Cardito, C.; Esposito, R.; Cimmino, A.; Giarra, A.; Trifuoggi, M.; Raimondo, S.; Notari, T.; et al. Discovery of the Involvement in DNA Oxidative Damage of Human Sperm Nuclear Basic Proteins of Healthy Young Men Living in Polluted Areas. Int. J. Mol. Sci. 2020, 21, 4198.
11. Aitken, R.J.; Curry, B.J. Redox regulation of human sperm function: From the physiological control of sperm capacitation to the etiology of infertility and DNA damage in the germ line. Antioxid. Redox Signal. 2011, 14, 367–381. Antioxidants 2022, 11, 477 15 of 22.
12. Deng,C.; Li, T.; Xie, Y.; Guo, Y.; Yang, Q.Y.; Liang, X.; Deng, C.H.; Liu, G.H. Sperm DNA fragmentation index influences assisted reproductive technology outcome: A systematic review and meta-analysis combined with a retrospective cohort study. Andrologia 2019, 51, e13263.
13. Mortimer, D.; Cohen, J.; Mortimer, S.T.; Fawzy, M.; McCulloh, D.H.; Morbeck, D.E.; Pollet-Villard, X.; Mansour, R.T.; Brison, D.R.; Doshi, A.; et al. Cairo consensus on the IVF laboratory environment and air quality: Report of an expert meeting. Reprod. Biomed. Online 2018, 36, 658–674.
14. Truong TT, Soh YM, Gardner DK. Antioxidants improve mouse preimplantation embryo development and viability. Hum Reprod. 2016;31:1445–54.
15. Truong T, Harvey AJ, Gardner DK. Antioxidant supplementation of mouse embryo culture or vitrification media support more in-vivo-like gene expression post-transfer. Reprod Biomed Online. 2022;44:393–410.
16. Gardner D.K, Kuramoto T., Miho T., Mitzumoto S., Montag M. và Atsumi Y. Prospective randomized multicentre comparison on sibling oocytes comparing G-Series media system with antioxidants versus standard G-Series media system. Reproductive BioMedicine Online. (2020), Volume 40, Issue 5, 637 – 644.
17. Phang Y., Song S., Kit A., Chen J., Wong P. Effects of combined antioxidants in culture media on embryo development and blastocyst ploidy status. Reproductive Biomedicine Online. (2024). Volume 48. Supplement 1, 104009.
18. Mizumoto S., Nagao Y., Watanabe H., Tanaka K., Kuramoto T. Culture media with antioxidants improved preimplantation embryo development and clinical outcomes of patients of advanced age. Reprod Biomed Online. (2025) Jan;50(1):104415.
19. Ueno S., Ito M., Shimazaki K., Okimura T., Uchiyama K., Yabuuchi A., Kato K. Comparison of embryo and clinical outcomes in different types of incubator between two different embryo culture systems. Reprod Sci. (2021);28(8):2301-2309. doi: 10.1007/s43032-021-00504-7. Epub 2021 Mar 9. PMID: 33751461
Thứ bảy ngày 22 . 11 . 2025 (9:30 - 12:00), khách sạn Equatorial (số ...
New World Saigon Hotel, thứ bảy ngày 17 tháng 01 năm 2026
Hội Nội tiết Sinh sản và Vô sinh TP. Hồ Chí Minh (HOSREM) sẽ ...

Ấn phẩm CẬP NHẬT KIẾN THỨC VỀ QUẢN LÝ SỨC KHỎE TUỔI MÃN ...
Y học sinh sản được phát ngày ngày 21 . 9 . 2025 và gởi đến ...
Cẩm nang Hội chứng buồng trứng đa nang được phát hành online ...








